Nomenclatura oxizilor, tipuri, proprietăți și exemple
oxizi ele sunt o familie de compuși binari în care există interacțiuni între element și oxigen. Deci un oxid are o formulă foarte generală de tip EO, unde E este orice element.
În funcție de numeroși factori, cum ar fi natura electronică a lui E, raza sa ionică și valențele sale, se pot forma diferite tipuri de oxizi. Unele sunt foarte simple și altele, cum ar fi Pb3O4, (numite minium, arcazón sau plumb roșu) sunt amestecate; adică rezultă din combinarea a mai mult de un oxid simplu.

Dar complexitatea oxizilor poate merge mai departe. Există amestecuri sau structuri în care pot interveni mai mult de un metal și unde proporțiile nu sunt stoichiometrice. În cazul Pb3O4, raportul Pb / O este egal cu 3/4, din care atât numerotatorul, cât și numitorul sunt numere întregi.
În oxizi non-stoichiometric proporțiile sunt numere zecimale. E0.75O1.78, este un exemplu de oxid non-stoichiometric ipotetic. Acest fenomen are loc cu așa-numitele oxizi metalici, în special cu metalele de tranziție (Fe, Au, Ti, Mn, Zn, etc.).
Cu toate acestea, există oxizi ale căror caracteristici sunt mult mai simple și mai ușor de diferențiat, ca și caracterul ionic sau covalent. În acei oxizi în care predomină caracterul ionic, aceștia vor fi compuși din cationii E+ și anionii O2-; și cele pur covalent, simplu (E-O) sau dublu (E = O) obligațiuni.
Ceea ce dictează caracterul ionic al unui oxid este diferența în electronegativitatea dintre E și O. Atunci când E este un metal foarte electropozitiv, atunci EO va avea un caracter ionic înalt. În timp ce dacă E este electonegativ, și anume un nonmetal, oxidul său de EO va fi covalent.
Această proprietate definește multe altele expuse de oxizi, ca și capacitatea lor de a forma baze sau acizi în soluție apoasă. De aici apar așa-numitele oxizi de bază și acidiști. Cei care nu se comportă ca oricare dintre cei doi, sau care, dimpotrivă, manifestă ambele caracteristici, sunt oxizi neutri sau amfoterici.
index
- 1 Nomenclatură
- 1.1 Nomenclatura sistematică
- 1.2 Nomenclatura stocurilor
- 1.3 Nomenclatura tradițională
- 2 Tipuri de oxizi
- 2.1 Oxizi de bază
- 2.2 Oxizi de acid
- 2.3 Oxizi neutri
- 2.4 Oxizi amfoterici
- 2.5 Oxizi amestecați
- 3 Proprietăți
- 4 Cum se formează?
- 5 Exemple de oxizi
- 5.1. Oxizi de metale tranziționale
- 5.2 Exemple suplimentare
- 6 Referințe
nomenclatură
Există trei moduri de a menționa oxizii (care se aplică și pentru mulți alți compuși). Acestea sunt corecte indiferent de caracterul ionic al oxidului de EO, deci numele lor nu spun nimic despre proprietățile sau structurile lor.
Nomenclatura sistematică
Având în vedere oxizii EO, E2O, E2O3 și EO2La prima vedere, ceea ce se află în spatele formulelor lor chimice nu poate fi cunoscut. Cu toate acestea, numerele indică proporțiile stoichiometrice sau raportul E / O. Din aceste numere le pot fi date nume, deși nu este specificat cu ce valență "funcționează" E.
Numerele de atomi atât pentru E cât și pentru O sunt indicate de prefixele grecești. În acest fel, mono- înseamnă că există un singur atom; di-, doi atomi; tri, trei atomi și așa mai departe.
Apoi, numele oxizilor anteriori conform nomenclaturii sistematice sunt:
-Acesta chignonE (EO) oxid.
-Acesta chignonoxid diE (E2O).
-Trioxid de diE (E2O3).
-diE oxid (EO2).
Aplicând apoi această nomenclatură pentru Pb3O4, oxidul roșu al primei imagini, avem:
Pb3O4: tetraoxid de triplumb.
Pentru multe oxizi amestecați sau cu rapoarte stoichiometrice înalte, este foarte util să se recurgă la denumirea sistematică a nomenclaturii sistematice.
Nomenclatura stocurilor
Valencia
Deși nu se știe care element este E, este suficient cu raportul E / O să știe ce valență folosește în oxidul său. Cum? Prin principiul electroneutralității. Aceasta necesită ca suma încărcărilor ionilor dintr-un compus să fie egală cu zero.
Aceasta se face prin asumarea unui caracter ionic ridicat pentru orice oxid. Astfel, O are sarcina -2 deoarece este O2-, iar E trebuie să furnizeze n + astfel încât să neutralizeze încărcăturile negative ale anionului de oxid.
De exemplu, în EO atomul E funcționează cu valența +2. De ce? Pentru că altfel nu a putut neutraliza sarcina -2 a singurului O. Pentru E2Sau, E are valența +1, deoarece sarcina +2 trebuie împărțită între cei doi atomi ai lui E.
Și în E2O3, trebuie să se calculeze mai întâi taxele negative contribuite de O. Ca și trei, atunci: 3 (-2) = -6.-6 pentru a neutraliza sarcina necesară pentru a aduce E 6, ci pentru că există două dintre ele, 6 este împărțit de două, cu E valență +3.
Regulă mnemonică
O are întotdeauna valența -2 în oxizi (dacă nu este un peroxid sau superoxid). Deci, un mnemonic pentru a determina valența E este pur și simplu să se ia în considerare numărul care însoțește O. E, între timp, îl va însoți numărul 2, iar dacă nu, înseamnă că a existat o simplificare.
De exemplu, în EO valența lui E este +1, deoarece chiar dacă nu este scrisă, există doar o O. Și pentru EO2, Pentru a fi nici un E 2 însoțitoare, a existat o simplificare și pentru a afișa trebuie multiplicată cu 2. Astfel, formula este ca E2O4 iar valența lui E este apoi +4.
Cu toate acestea, această regulă nu reușește pentru niște oxizi, cum ar fi Pb3O4. Prin urmare, este întotdeauna necesar să se efectueze calculele de neutralitate.
Din ce constă?
Odată ce valența E este la îndemână, nomenclatura stocului constă în specificarea acesteia în paranteze și cu cifre romane. Din toate nomenclatoarele, aceasta este cea mai simplă și cea mai precisă în ceea ce privește proprietățile electronice ale oxizilor.
Dacă E, pe de altă parte, are doar o singură valență (care poate fi găsită în tabelul periodic), atunci nu este specificată.
Astfel, pentru oxidul EO, dacă E are valența +2 și +3, se numește: oxid de (denumirea lui E) (II). Dar dacă E are doar valența +2, atunci oxidul său se numește: oxid (denumirea lui E).
Nomenclatura tradițională
Pentru a menționa numele oxizilor trebuie adăugate la numele lor latine -OS -ico sau sufixe, pentru valențele mai mari sau mai mici. În cazul în care există mai mult de două, atunci acesta utilizează prefixul sughiță pentru cel mai mic, și -per, pentru cele mai multe dintre toate.
De exemplu, plumbul funcționează cu valențele +2 și +4. În PbO are valența +2, deci se numește: oxid plumb. În timp ce PbO2 Se numește: oxid plumic.
Și Pb3O4, cum se numește în conformitate cu cele două nomenclaturi anterioare? Nu are nume. De ce? Deoarece Pb3O4 constă de fapt dintr-un amestec 2 [PbO] [PbO2]; adică, solidul roșu are o concentrație dublă de PbO.
Din acest motiv ar fi greșit să încerci să dai un nume Pb3O4 care nu constă din nomenclatura sistematică sau din slangul popular.
Tipuri de oxizi
În funcție de ce parte a tabelului periodic este E și, prin urmare, natura sa electronică, se poate forma un tip de oxid sau altul. De aici apar mai multe criterii pentru a le atribui un tip, dar cele mai importante sunt cele referitoare la aciditatea sau bazicitatea lor.
Oxizi de bază
Oxizii de bază se caracterizează prin faptul că sunt ionici, metalici și, mai important, generând o soluție bazică atunci când sunt dizolvați în apă. Pentru a determina experimental dacă un oxid este bazic, acesta trebuie adăugat la un recipient cu apă și un indicator universal dizolvat în el. Colorarea sa inainte de a adauga oxidul trebuie sa fie verde, pH neutru.
Odată ce oxidul este adăugat la apă, dacă culoarea sa se schimbă de la verde la albastru, înseamnă că pH-ul a devenit fundamental. Acest lucru se datorează faptului că stabilește un echilibru de solubilitate între hidroxidul format și apa:
EO (s) + H2O (l) => E (OH)2(e) <=> E2+(ac) + OH-(Aq)
Deși oxidul este insolubil în apă, este suficient ca o porție mică să se dizolve pentru a modifica pH-ul. Unele oxizi de bază sunt atât de solubile încât generează hidroxizi caustici precum NaOH și KOH. Adică, oxizii de sodiu și potasiu, Na2O și K2Sau, ele sunt foarte de bază. Observați valența +1 pentru ambele metale.
Acid oxizi
Oxizii acide sunt caracterizați prin faptul că au un element nemetalic, sunt covalenți și, de asemenea, generează soluții acide cu apă. Din nou, aciditatea sa poate fi verificată cu indicatorul universal. Dacă de această dată prin adăugarea oxidului în apă, culoarea sa verde devine roșiatică, atunci este un oxid acid.
Ce reacție are loc? Următoarele:
EO2(s) + H2O (l) => H2EO3(Aq)
Un exemplu de oxid de acid, care nu este un solid, dar un gaz, este CO2. Când se dizolvă în apă, formează acid carbonic:
CO2(g) + H2O (l) <=> H2CO3(Aq)
De asemenea, CO2 Nu conține anioni O2- și cationii C4+, dar într-o moleculă formată prin legături covalente: O = C = O. Aceasta este probabil una dintre cele mai mari diferențe dintre oxizii de bază și acizi.
Oxizi neutri
Acești oxizi nu modifică culoarea verde a apei la pH neutru; adică nu formează hidroxizi și nici acizi în soluție apoasă. Unele dintre ele sunt: N2O, NO și CO. Ca și CO, au legături covalente care pot fi ilustrate de structurile lui Lewis sau de orice teorie a legăturilor.
Oxizi amfoterici
O altă modalitate de a clasifica oxizii depinde de faptul dacă reacționează cu un acid sau nu.Apa este un acid foarte slab (și o bază de asemenea), astfel încât oxizii amfoterici nu prezintă "ambele părți". Acești oxizi se caracterizează prin reacția cu acizi și baze.
Oxidul de aluminiu, de exemplu, este un oxid amfoteric. Următoarele două ecuații chimice reprezintă reacția lor cu acizi sau baze:
la2O3(s) + 3H2SW4(ac) => Al2(SO4)3(ac) + 3H2O (l)
la2O3(s) + 2NaOH (ac) + 3H2O (1) => 2NaAl (OH)4(Aq)
Al2(SO4)3 este sarea de sulfat de aluminiu și NaAI (OH)4 o sare complexă numită aluminat de tetrahidroxid de sodiu.
Oxid de hidrogen, H2Sau (apă), este, de asemenea, amfoteric, iar acest lucru este evidențiat în echilibrul său de ionizare:
H2O (l) <=> H3O+(ac) + OH-(Aq)
Oxizi combinate
Oxizii amestecați sunt cei care constau din amestecul de unul sau mai mulți oxizi din același solid. Pb3O4 Acesta este un exemplu al acestora. Magnetitul, Credința3O4, este de asemenea un alt exemplu de oxid mixt. Credința3O4 Este un amestec de FeO și Fe2O3 în proporții de 1: 1 (spre deosebire de Pb)3O4).
Amestecurile pot fi mai complexe, provocând astfel o bogată varietate de minerale de oxid.
proprietăţi
Proprietățile oxizilor depind de tipul lor. Oxizii pot fi ionici (En +O2-), cum ar fi CaO (Ca2+O2-) sau covalent, cum ar fi SO2, O = S = O.
Din acest fapt și din tendința ca elementele să reacționeze cu acizi sau baze, se colectează pentru fiecare oxid un număr de proprietăți.
De asemenea, cele de mai sus se reflectă în proprietățile fizice, cum ar fi punctele de topire și de fierbere. Oxizii ionici tind să formeze structuri cristaline foarte rezistente la căldură, astfel că punctele lor de topire sunt ridicate (peste 1000 ° C), în timp ce topitura covalentă la temperaturi scăzute sau chiar gaze sau lichide.
Cum se formează?
Oxizii se formează atunci când elementele reacționează cu oxigenul. Această reacție poate apărea cu un contact simplu cu atmosfere bogate în oxigen sau necesită căldură (cum ar fi flacăra unui brichetă). Adică atunci când un obiect este ars, acesta reacționează cu oxigenul (atâta timp cât este prezent în aer).
Dacă se ia o bucată de fosfor, de exemplu, și se pune în flacără, se va arde și se va forma oxidul corespunzător:
4P (s) + 5O2(g) => P4O10(S)
În timpul acestui proces, unele solide, cum ar fi calciul, pot arde cu o flacără luminată și colorată.
Un alt exemplu este obținut prin arderea lemnului sau a oricărei substanțe organice care posedă carbon:
C (s) + O2(g) => CO2(G)
Dar dacă există o insuficiență de oxigen, se formează CO în loc de CO2:
C (s) + 1/202(g) => CO (g)
Rețineți cum este folosit raportul C / O pentru a descrie oxizi diferiți.
Exemple de oxizi
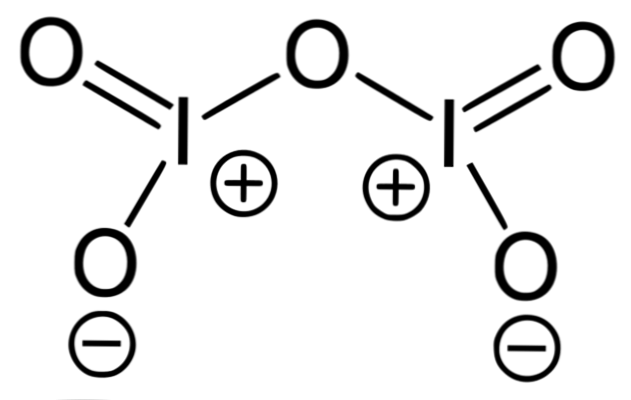
Imaginea superioară corespunde structurii oxidice covalente I2O5, cea mai stabilă formă de iod. Observați legăturile sale simple și duble, precum și încărcăturile oficiale ale lui I și ale oxigenului pe laturile sale.
Oxizii de halogen sunt caracterizați prin faptul că sunt covalenți și foarte reactivi, ca atare cazurile de O2F2 (F-0-O-F) și OF2 (F-O-F). Dioxidul de clor, ClO2, de exemplu, este singurul oxid de clor care este sintetizat la scară industrială.
Deoarece halogeni formează oxizi covalenți, valențele lor "ipotetice" sunt calculate în același mod prin principiul electroneutralității.
Oxizi de metale tranziționale
În plus față de oxizii de halogen, avem oxizii metalelor de tranziție:
-CoO: oxid de cobalt (II); oxidul cobaltos; u monoxid de cobalt.
-HgO: oxid de mercur (II); oxidul mercuric; u monoxid de mercur.
-ag2O: oxid de argint; oxidul de argint; sau monoxid de diplomat.
-Au2O3: oxid de aur (III); oxid aureic; sau dioxid trioxid.
Exemple suplimentare
-B2O3: oxid de bor; oxid boric; sau trioxid de dibor.
-CI2O7: oxidul de clor (VII); oxidul percloric; diclorheptoxid.
-NO: oxid de azot (II); oxidul nitric; monoxid de azot.
referințe
- Shiver & Atkins. (2008). Chimie anorganică (a patra ediție). Mc Graw Hill.
- Oxizi metalici și nemetalici. Luată de la: chem.uiuc.edu
- Free Chemistry Online. (2018). Oxizi și ozon. Luat de la: freechemistryonline.com
- Toppr. (2018). Oxizi simpli. Luat de la: toppr.com
- Steven S. Zumdahl. (7 mai 2018). Oxideaza. Enciclopedie Britanică. Luat de la: britannica.com
- Chimie LibreTexts. (24 aprilie 2018). Oxizii. Luat de la: chem.libretexts.org
- Quimicas.net (2018). Exemple de oxizi. Recuperat de la: quimicas.net


