Oxidul de aluminiu (Al2O3) Structura chimică, utilizările, proprietățile
oxid de aluminiu (Al2O3 de forma chimică), denumită și alumină, oxid de aluminiu, corund sau trioxid de aluminiu, este un oxid metalic care este produs din reacția dintre un metal și oxigen (O). Este, de asemenea, cunoscut ca oxid de bază, pentru ușurarea formării de hidroxizi atunci când reacționează cu apa.
Acest lucru se datorează faptului că aluminiul care este în familia IIIA a mesei periodice are tendința de a da electronii ultimului nivel de energie. Această tendință se datorează naturii sale metalice și electronegativității sale scăzute (1,61 pe scara Pauling), care îi conferă proprietăți electropositive și o transformă într-un cation.

În schimb, oxigenul este nemetalic și este mai electronegativ datorită electronegativității ridicate (3,44 pe scara Pauling). Prin urmare, are tendința de a stabiliza energia electronică a ultimului său nivel prin acceptarea electronilor, ceea ce îl face un anion.
Legăturile formate sunt legături puternice, care conferă oxidului de aluminiu o mare rezistență. În natură, aluminiul nu este găsit în formă nativă, cum ar fi aurul, argintul, cuprul, sulful și carbonul (diamantul).
Aceasta înseamnă că aluminiul nu este combinat cu niciun alt element; Acest metal este amestecat cu oxigen, formând compuși cum ar fi corundul sau smirna, care sunt compuși foarte rezistenți și abrazivi.
index
- 1 Formula și structura chimică
- 2 Proprietăți fizice
- 3 Proprietăți chimice
- 4 Utilizări
- 5 Referințe
Formula și structura chimică
Formula moleculară: Al2O3
Formula structurală: 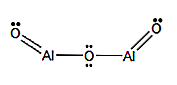
Proprietăți fizice
- Este disponibil în comerț sub formă de pulbere albă, inodor și netoxic.
- Ca compus mineral, corespunde grupului de hematiți. Este un material foarte dur, care are rezistență mare la uzură, deci este folosit ca material abraziv.
- Conduce electricitatea cu ușurință și este, de asemenea, un bun conductor termic.
- Este rezistent la reacții cu acizi și baze la temperaturi ridicate.
- Pot apărea în diferite culori: roșu sau rubin (unde ionii de aluminiu au fost înlocuiți cu Cr3+), galben, roz, albastru safir, violet, verde, gri și chiar incolor.
- Luminozitatea sa este vitrioasă sau adamantină (diamant)
- Are o dungă albă foarte delicată datorită durității sale.
- duritatea sa în scara lui Mohs este de 9. Aceasta înseamnă că poate zgâria alte minerale cu duritate mai mică decât ea; cu toate acestea, nu poate zgâria diamantul care are o duritate de 10 pe aceeași scală.
- Densitatea sa este de 3,96 g / cm3
- Greutatea sa moleculară (masa molară) este de 101,96 g / mol.
- Punctul său de topire este 2040 ° C.
- Punctul de fierbere este de 2977 ° C
- Este insolubil în apă.
Proprietăți chimice
Oxidul de aluminiu nu reacționează cu apa decât dacă este în prezența unei baze puternice.
Cu toate acestea, atunci când reacționează cu acizi se comportă ca și cum ar fi o bază:

De asemenea, prezintă proprietăți acide atunci când reacționează cu baze:

Deși nu se formează apă în această reacție, se consideră acidă deoarece Al2O3 neutralizează NaOH. Prin urmare, Al2O3 Este clasificat ca un oxid amfoteric deoarece are proprietăți acide și de bază.
În formarea alchenelor și cicloalcenelor, una dintre formele cele mai utilizate în industrie și laborator este prin deshidratarea alcoolilor.
Pentru aceasta, vaporii de alcool circulă pe un catalizator fierbinte de alumină sau oxid de aluminiu (Al2O3); în acest caz se consideră acid Lewis.

aplicații
- Alumina este utilizată în industrie pentru obținerea aluminiului.
- Este folosit ca material ceramic datorită rezistenței sale ridicate la coroziune la temperaturi ridicate și uzură.
- Se utilizează ca izolație termică, în special în celulele electrolitice.
- Are capacitatea de a absorbi apa, ceea ce îl face adecvat pentru a fi folosit ca agent de uscare.
- Se utilizează ca agent catalitic în reacțiile chimice
- datorită stabilității sale termice ridicate, este utilizat ca oxidant în reacțiile chimice care se desfășoară la temperaturi ridicate.
- Previne oxidarea terminalelor catodice și anodice într-o celulă electrolitică.
- Datorită marii sale durități și rezistenței, este utilizat în stomatologie pentru prepararea pieselor dentare.
- Este un bun izolator electric în bujiile vehiculelor care funcționează cu benzină.
- Este utilizat pe scară largă în fabricile de bile pentru prepararea ceramicii și a emailurilor.
- datorită greutății sale ușoare, în procesele tehnologice se utilizează pentru fabricarea avioanelor.
- Din cauza punctului său de fierbere ridicat, este folosit pentru a realiza unelte de bucătărie, cum ar fi tigăi și tigăi refractare.
- Se folosește în instrumentația mașinilor de testare termică.
- În industria electronică se utilizează la fabricarea componentelor pasive pentru interconectarea electrică și la fabricarea rezistențelor și condensatoarelor.
- utilizat la fabricarea materialelor de umplutură pentru sudare.
- Oxidul de aluminiu este utilizat pentru acoperirea oxidului de titan (pigment utilizat pentru vopsele și hârtie din plastic).Acest lucru previne reacțiile dintre mediul înconjurător și acest tip de pigmenți, care nu se descompune și nu se rutează.
- Este folosit ca abraziv în pastele de dinți.
- Se utilizează la hemodializă.
- Ca aditiv în industria alimentară, deoarece este utilizat ca agent de dispersie.
- Este un agent antiperspirant de deodorante.
- Oxidul de aluminiu a fost folosit ca material ortopedic. Deoarece este un material inert și poros, îl face potrivit pentru utilizare în acest tip de implanturi. Aceste implanturi permit incarnarea fibrovascular, deci fibroblaste și osteoblaste proliferează rapid în acest material.
- Implantul bioceramic este fabricat din alumină. Este ușor și are o structură uniformă a porilor foarte bine interconectată între ele. Structura microcristalină este mai fină decât suprafața aspră. Prezintă mai puțină inflamabilitate după o perioadă postoperatorie comparativ cu alte materiale utilizate pentru implanturi.
- fulgii de oxid de aluminiu produc efecte reflexive în interiorul vopselelor utilizate pentru automobile.
- În unele rafinării, oxidul de aluminiu este utilizat pentru a transforma gazele toxice ale hidrogenului sulfurat în sulf elementar.
- Forma de alumină numită alumină activată are mari beneficii in tratarea apelor uzate ca acvifere datorită capacității lor de a adsorbi multor poluanți dăunătoare mediului, și, de asemenea, pentru a filtra materialul rezidual este dizolvat în apă și este mai mare decât porii foilor de alumină.
referințe
- Chang, R; chimie, 1992, (a patra ediție), Mexic. McGraw-Hill Interamericana de México.
- Pine.S; Hendrickson, J; Cram, D; Hammond, G (1980), Chimie organică, (a patra ediție), Mexic, McGraw-Hill de México
- Kinjanjui, L., (s.f) Proprietăți și utilizări ale oxidului de aluminiu,Încă funcționează, Recuperat, histillworks.com
- Panjian L., Chikara, O., Tadashi, K., Kazuki, N., Naohiro, S., "și" Klaas G., (1994). Rolul silicei hidratate, al titanului și aluminei în inducerea apatitei pe implanturi. Journal of Biomedicals Materials Research. Volumul 18, pp. 7-15. DOI: 10.1002 / jbm.820280103.
- Informații Ghid complet pentru Roci, minerale și Gemstones., Mineral.net., Recuperat, minerals.net
- LaNore, S. (2017), Caracteristicile fizice ale oxidului de aluminiu, sciencing,Recuperat, sciencing.com



