Oxid cupric Formula, proprietăți, riscuri și utilizări
oxidul de cupru, denumit și oxid de cupru (II), este un compus chimic cu formula CuO. Structura sa este prezentată în Figura 1 (EMBL-EBI, 2017).
Oxidul de cupru se găsește în natură ca una dintre componentele mineralelor, cum ar fi tenoritul și parametlaconitul. Este extras din minerale din întreaga lume, în principal în America de Sud, în țări precum Peru și Bolivia.
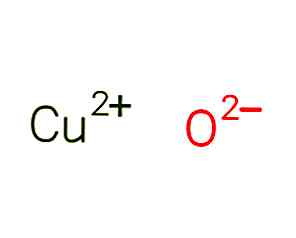
Unii compuși chimici, cum ar fi carbonatul de amoniu și amoniacul, sunt utilizați pentru a promova extracția mineralelor.

Oxidul de cupru este produs în principal prin extracția în minerale, cu toate acestea există un proces pentru a-l produce industrial.
În industrii, oxidul cupric este preparat prin reacția de aprindere a azotatului cupric trihidrat (100-20 ° C), hidroxidului cupric (100 ° C) sau a carbonatului de cupru (250 ° C):
2Cu (NO3)2 → 2CuO + 4NO2 + O2
Cu (OH)2(s) → CuO (s) + H2O (l)
Čuĉo3 → CuO + CO2
Se prepară, de asemenea, sintetic prin încălzirea cuprului metalic în aer la circa 800 ° C (oxid de cupru Formula, S.F.).
Proprietățile fizice și chimice ale oxidului cupric
Oxid de cupru (II) Se pare ca o pulbere neagra fină cu o structură ionică. Aspectul său este prezentat în figura 3.

Molecula este formată de cuprul cationic divalent Cu + 2 și de oxigenul anionic O-2. Moleculele formează un sistem cristalin monoclinic, în care fiecare atom de cupru este coordonat de 4 atomi de oxigen.
Este strâns legată de celălalt oxid de cupru: Oxid cupros cu Cu2O (Centrul Național pentru Biotehnologii Informaționale, 2005).
Masa sa moleculară este de 79,545 g / mol și densitatea sa este de 6,315 g / ml. Punctul său de topire este 1326 ° C, unde se descompune oxigenul de eliberare, punctul de fierbere este peste 2000 ° C.
Compusul este insolubil în apă, alcool, hidroxid de amoniu, carbonat de amoniu și este solubil în clorură de amoniu și cianură de potasiu (Royal Society of Chemistry, 2015).
Oxidul de cupru este amfoteric, astfel încât se poate dizolva în acizi și soluții alcaline. În soluția alcalină reacționează pentru a forma alte săruri de cupru:
2MetalOH + CuO + H2O → Metal2[Cu (OH)4]
În soluțiile acide, reacționează și pentru a forma alte săruri de cupru:
CuO + 2HNO3 → Cu (NO3)2 + H2O
CuO + 2HCI - CuCI2 + H2O
Acesta explodează când este încălzit în contact cu aluminiu, hidrogen sau magneziu. De asemenea, atunci când este încălzit, produce vapori toxici.
Reactivitate și pericole
Oxidul de cupru (II) este extrem de otrăvitor și toxic de ingerare. Aceasta provoacă daune sistemului nervos central și sistemului endocrin (AZoM, 2013).
De asemenea, este iritant pentru ochi și piele. Este neinflamabil, stabil și incompatibil cu agenții reducători, hidrogen sulfurat, aluminiu, metale alcaline, metale fin sub formă de pulbere (Fisher scientiffic, 2009).
În cazul contactului cu ochii, trebuie să verificați dacă purtați lentile de contact și să le eliminați imediat.
Ochii trebuie spălați cu apă curentă timp de cel puțin 15 minute, ținând pleoapele deschise. Puteți folosi apă rece. Unguentul nu trebuie utilizat pentru ochi.
Dacă produsul chimic vine în contact cu hainele, scoateți-l cât mai repede posibil, protejându-vă mâinile și corpul. Așezați victima sub un duș de siguranță.
Dacă produsul se acumulează pe pielea expusă a victimei, cum ar fi mâinile, spălați ușor și cu atenție pielea contaminată cu apă curgătoare și săpun neabraziv.
Puteți folosi apă rece. Dacă iritația persistă, solicitați asistență medicală. Spălați hainele contaminate înainte de reutilizare.
În cazul în care contactul cu pielea este grav, trebuie să fie spălat cu un săpun dezinfectant și să acoperiți pielea contaminată cu o cremă antibacteriană.
În cazul inhalării, victima ar trebui să aibă dreptul de a se odihni într-o zonă bine ventilată. În cazul în care inhalarea este severă, victima trebuie evacuată într-o zonă sigură cât mai curând posibil.
Slăbiți îmbrăcămintea strânsă cum ar fi gulerul cămășii, centurile sau cravată Dacă victima găsește dificil să respire, oxigenul trebuie administrat.
Dacă victima nu respiră, se face o resuscitare de la gură la gură. întotdeauna luând în considerare faptul că poate fi periculos pentru persoana care acordă un ajutor pentru a da resuscitare gura la gura atunci când materialul inhalat este toxic, infecțioase sau corozive.
În caz de ingerare, nu provocați voma. Slăbiți îmbrăcămintea strânsă, cum ar fi gulerul cămășii, centurile sau cravatele. Dacă victima nu respira, efectuați o resuscitare din gură.
În toate cazurile, ar trebui să se caute imediat asistență medicală (Fișă tehnică de securitate pentru oxidul cupric, 2013).
aplicații
Oxidul de cupru este folosit ca pigment pentru cristale, emailuri din porțelan și pietre artificiale. Oxidul adaugă o nuanță albăstruie până la verde la astfel de materiale.
De asemenea, este utilizat ca agent de desulfurare pentru gazele petroliere și ca catalizator de oxidare și în electrozi galvanici (Encyclopædia Britannica, 2017).
Oxidul de cupru este utilizat pe scară largă în industria chimică și chimică agricolă pentru a produce produse intermediare în anumite procese.
Este un agent de oxidare / reducere utilizat pe scară largă și un regulator al procesului în reacția chimică, în special în producția de petrol.
Oxidul de cupru este utilizat pentru a produce vopsele și acoperiri și este, de asemenea, un ingredient în unele produse de îngrijire a aerului.
Rare folosit ca supliment alimentar la animale, are de asemenea aplicație ca un semiconductor de tip p datorită decalajului său de bandă îngustă. Este folosit ca o alternativă pentru oxidul de fier din termite.
Datorită proprietăților sale fungicide și microbicide, oxidul de cupru (II) se găsește, de asemenea, ca insecticid și fumigant.
Se folosește în principal în tratarea plantelor de cartofi și ca agent antivegetativ în carcasele navelor. Un agent antivegetativ este un material care împiedică formarea barnaculelor și a altor organisme în fundul unei nave.
Când aceste organisme cresc în corpul unei nave, ele măresc fricțiunile produse atunci când nava trece prin apă, reducând astfel viteza.
Compusul este de asemenea utilizat ca conservant al lemnului, pentru a proteja stâlpii de gard, talpa, terasele, acoperișurile, șindrilele, pereții marini și alte structuri de apă dulce și marine și insecte și ciuperci (Thomson Gale, 2006).
referințe
- (2013, 21 august). Cupru (II) Oxide Semiconductori. Adus de la azom.com.
- Formula oxidului cupric. (S.F.). Recuperat de la softschools.com.
- EMBL-EBI. (2017, 2 februarie). oxidul de cupru (II). Adus de la ChEBI.ac.uk.
- Encyclopædia Britannica. (2017, 16 mai). Cupru (Cu). Recuperat de la britannica.com.
- Știință pentru pescuit. (2009, 20 septembrie). Fisele tehnice de securitate pentru produs: Oxid de cupru (II). Adus de la fke.uitm.edu.my.my.
- Fișă tehnică de securitate Oxid cupric. (2013, 21 mai). Adus de la sciencelab.com.
- Centrul Național de Informații Biotehnologice ... (2005, 26 martie). Baze de date compuse PubChem; CID = 14829. Adus de la PubChem.
- Societatea Regală de Chimie. (2015). Oxid de cupru (II). Adus de la chemspider.com.
- Thomson Gale. (2006). Oxid de cupru (II). Adus de la encyclopedia.com.


