Oxidul de plumb (PbO) Formula, proprietățile, riscurile și utilizările
oxid uscat, cunoscut și ca oxid de plumb (II) sau monoxid de plumb, este un compus chimic cu formula PbO. Se găsește în două polimorfe: litharge și masicotit. Structura sa este ilustrată în figura 1.
Revenind la compoziție, litharge este produsul oxidat al plumbului topit care a fost agitat sau atomizat pentru a încorpora aerul, apoi s-a răcit și s-a măcinat pentru a forma pulberea galbenă.
Denumirea masicotit este utilizată atât pentru produsul mineral nativ, cât și pentru produsul monoxid de plumb produs prin încălzirea carbonatului de plumb la 300 ° C (monoxid de plumb, 2016). Aceste minerale sunt prezentate în figura 2.

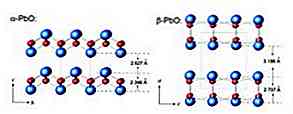
Masochitul are o structură ortorombică în timp ce litharge are o structură cristalină tetragonală. Oxidul de plumb (II) are capacitatea de a schimba structura atunci când este încălzit sau răcit. Aceste structuri sunt prezentate în Figura 3.
PbO este produs prin oxidarea plumbului metalic. Metalul se topește pentru a obține comprimate de plumb și apoi se macină între 170-210 ° C și trece prin flacără pentru oxidare la temperaturi de peste 600 ° C. Produsele de oxid sunt zdrobite pentru a obține oxidul de plumb finit (Kirk-Othmer, 1995).
2Pb + O2 → 2PbO
PbO este produs pe scară largă ca produs intermediar în rafinarea mineralelor plumb din plumb metalic. Mineritul de plumb utilizat este galena (sulfura de plumb (II)). La o temperatură ridicată (1000 ° C), sulful este transformat în oxid în felul următor:
2PbS + 3O2 → 2PbO + 2S02
index
- 1 Proprietățile fizice și chimice ale oxidului plumb
- 2 Reactivitate și pericole
- 3 Utilizări
- 4 Referințe
Proprietățile fizice și chimice ale oxidului plumb
Monoxidul de plumb poate prezenta două apariții diferite: pudră galbenă uscată cu structură ortorombică (masicotită) sau ca cristale tetragonale roșii (litharge). Ambele forme sunt ilustrate în figura 4.

Compusul are o greutate moleculară de 223,20 g / mol și o densitate de 9,53 g / ml. Are un punct de topire de 888 ° C și un punct de fierbere de 1470 ° C (Centrul Național de Informații Biotehnologii, S.F.).
Compusul nu este foarte solubil în apă, fiind capabil să se dizolve numai 0,0504 grame pentru fiecare litru la 25 ° C sub formă de masticită și 0,1065 grame pentru fiecare litru la 25 ° C sub formă de litharge. Compusul este de asemenea insolubil în alcool. Este solubil în acid acetic, HNO3 diluat și alcaline (Societatea Regală de Chimie, 2015).
Compusul este un agent slab oxidant sau reducător, totuși reacțiile redox pot să apară în continuare. Acești compuși nu sunt reactivi la apă.
Oxidul de plumb oxidează carbură de aluminiu cu incandescență atunci când este încălzită. Amestecurile de oxid de plumb cu pulbere de aluminiu (ca și alte metale: sodiu, zirconiu) dau o explozie violentă.
Reactivitate și pericole
Monoxidul de plumb este un compus clasificat drept otrăvitor. Substanța este toxică pentru sistemul nervos central și poate fi carcinogenă la om (fișa tehnică de securitate Material oxid de plumb, galben, 2013).
Simptomele otrăvirii precoce sunt linii de plumb care apar pe marginea gingiilor și pielea devine gri. Sindromul neurastenic va apărea și în perioada inițială de otrăvire.
Cerebellar otrăvire poate duce la depresie de otrăvire cu plumb, manie de la intoxicații cu plumb, precum și toxicitate plumb și sensibilitate la paralizie neuritis multiple.
Intoxicația cu plumb poate provoca, de asemenea, anemie hipocromă și tulburări metabolice și endocrine. În plus, otrăvirea cu plumb poate inhiba activitatea anumitor enzime în sistemul digestiv și poate provoca indigestie, dureri abdominale severe și leziuni hepatice. De asemenea, poate provoca hipertensiune arterială și creșterea colesterolului.
Dacă există dureri abdominale severe, se pot lua unele măsuri, cum ar fi: injectarea subcutanată a atropinei și a altor medicamente, abdominală caldă, clismă, baie de apă fierbinte și așa mai departe. Concentrația maximă permisă în aer este de 0,01 mg / m3 (monoxid de plumb, 2016).
În cazul contactului cu ochii sau pielea, spălați cu multă apă. În caz de inhalare sau ingestie, victima trebuie transportată într-un loc bine ventilat. Vărsăturile nu trebuie induse. Dacă victima nu respira, trebuie să se administreze resuscitare gură-la-gură.
În toate cazurile, trebuie să căutați imediat asistență medicală. Monoxidul de plumb este un compus dăunător pentru mediu, bioacumularea acestei substanțe chimice poate apărea în plante și mamifere.
Se recomandă insistent ca această substanță să nu pătrundă în mediul înconjurător, deci trebuie manipulată și depozitată în conformitate cu prevederile stabilite (Institutul Național pentru Siguranța și Sănătatea în Muncă, 2015).
aplicații
Monoxidul de plumb a fost folosit ca un uscător de vopsea și ca un flux scăzut de foc în fabricarea ceramicii și a sticlei.Plumbul din sticlă de sticlă este utilizat în fabricarea de tacamuri de înaltă calitate.
Folosind monoxid de plumb ca flux, este posibil să se obțină un pahar cu un indice de refracție ridicat și, în consecință, luciul dorit (Encyclopedia Britannica, 2016).
Conductoarele ceramice semi-metalice au cele mai înalte conductivități ale tuturor ceramicii, cu excepția celor superconductoare. Oxidul de plumb este un exemplu de acest tip de ceramică semi-metalică. Aceste materiale au suprapuse benzile de energie electronică și, prin urmare, sunt conductori electronici excelenți (Mason, 2008).
Oxidul de plumb este utilizat în principal în tuburi de electroni, tuburi de imagine, sticlă optică, sticlă cu raze X anti-raze X și cauciuc rezistent la radiații.
Se utilizează ca un reactiv analitic, fluxul de silicat, dar și pentru precipitarea aminoacizilor
Oxidul de plumb este utilizat în fabricarea stabilizatorului din PVC din plastic și este, de asemenea, materia primă a altor săruri de plumb. Este de asemenea utilizat în rafinarea uleiului și pentru determinarea aurului și a argintului.
Este de asemenea utilizat ca pigment galben în vopsele și emailuri. Masochitul a fost folosit ca pigment de către artiștii din secolele XV-XVIII.
Straturi subțiri de monoxid de plumb sunt folosite pentru a produce culori irizate în alamă și bronz. Amestecuri liange cu glicerol pentru a face ciment de la instalator.
referințe
- Enciclopedia britanică. (2016, 10 octombrie). Sticla. Recuperat de la britannica: britannica.com.
- Kirk-Othmer. (1995). Enciclopedia tehnologiei chimice. Ed. 4 Volumele 1. New York: John Wiley și Fiii.
- Monoxid de plumb. (2016, 1 mai). Adus de la cameo.mfa: cameo.mfa.org.
- Monoxid de plumb. (2016). Recuperat din chimicale: chembook.com.
- Mason, T. O. (2008, 12 martie). Ceramica conductivă. Recuperat de la britannica: britannica.com.
- Fis¸a˘ Tehnica˘ de Securitate În conformitate cu Directiva EC 91/155 / EEC (2013, 21 mai). Adus de la sciencelab: sciencelab.com.
- Centrul National de Informare Biotehnologica. (S.F.). Baze de date compuse PubChem; CID = 14827. Adus de la PubChem: pubchem.ncbi.nlm.nih.gov.
- Institutul Național de Siguranță și Sănătate Ocupațională. (2015, 22 iulie). OXID DE LEAD (II). Adus de la cdc.gov: cdc.gov.
- Societatea Regală de Chimie. (2015). Plumb (II) oxid. Recuperat de la chemspider: chemspider.com.


