Sulfura de aluminiu (Al2S3) Structura chimică, nomenclatură, proprietăți
sulfură de aluminiu (Al2S3) este un compus chimic de culoare gri, format prin oxidarea aluminiului metalic, prin pierderea electronilor ultimului nivel de energie si devine cation, si prin reducerea sulfului nemetalic, prin castigarea electronilor derivati din aluminiu si devenind un anioni.
Pentru ca acest lucru să se întâmple și aluminiul să-și producă electronii, este necesar să prezentăm trei spații orbitale hibride3, care dau posibilitatea formării legăturilor cu electronii proveniți din sulf.

Sensibilitatea sulfurii de aluminiu în apă înseamnă că, în prezența vaporilor de apă în aer, poate reacționa pentru a produce hidroxid de aluminiu (Al (OH)).3), hidrogen sulfurat (H2S) și hidrogen (H2) Pentru gaz; dacă acesta din urmă se acumulează, poate provoca o explozie. Prin urmare, ambalajul sulfurii de aluminiu trebuie să fie realizat folosind recipiente etanșe.
Pe de altă parte, deoarece sulfura de aluminiu are reactivitate cu apa, aceasta face ca acesta să fie un element care nu are solubilitate în solventul menționat.
index
- 1 Structura chimică
- 1.1 Formula moleculară
- 1.2 Formula structurală
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Proprietăți fizice
- 3.2 Proprietăți chimice
- 4 Utilizări și aplicații
- 4.1 În supercapacitorii
- 4.2 În bateriile secundare cu litiu
- 5 Riscuri
- 5.1 Procedura de prim ajutor
- 5.2 Măsuri de combatere a incendiilor
- 6 Referințe
Structura chimică
Formula moleculară
la2S3
Formula structurală
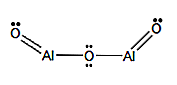 nomenclatură
nomenclatură
- Sulfura de aluminiu.
- Trisulfură di aluminiu.
- Sulfura de aluminiu (III).
- Sulfura de aluminiu.
proprietăţi
Compușii chimici prezintă mai ales două tipuri de proprietăți: fizice și chimice.
Proprietăți fizice
Masa moleculară
150,158 g / mol
densitate
2,02 g / ml
Punctul de topire
1100 ° C
Solubilitate în apă
insolubil
Proprietăți chimice
Una dintre principalele reacții ale sulfurii de aluminiu este cu apă, ca substrat sau reactiv principal:

În această reacție, formarea hidroxidului de aluminiu și a hidrogenului sulfurat poate fi observată dacă este sub formă de gaz sau hidrogen sulfurat dacă este dizolvată în apă sub formă de soluție. Prezenta sa este identificata de mirosul de oua putrezite.
Utilizări și aplicații
În supercapacitorii
Sulfura de aluminiu este utilizată în fabricarea structurilor de rețea nano care îmbunătățesc suprafața specifică și conductivitatea electrică, astfel încât să se poată obține o capacitate ridicată și o densitate energetică a căror aplicabilitate este cea a supercapacitorilor.
Graphenul (GO) - grafenul este una dintre formele alotropice de carbon - a servit drept suport pentru sulfura de aluminiu (Al2S3) cu o morfologie ierarhică similară celei a nanoraptanului fabricat utilizând metoda hidrotermală.
Acțiunea de oxid de grafen
Caracteristicile oxidului de grafen, ca suport, precum și conductivitatea electrică ridicată și aria de suprafață, fac ca nanomarcatul Al2S3 să fie activ electrochimic.
Curbele capacității specifice CV cu vârfuri redox bine definite confirmă comportamentul pseudo-capacitiv al nanorambutanilor Al2S3 Ierarhic, susținut în oxid de grafen în electrolit de NaOH 1M. Valorile capacității specifice CV obținute din curbe sunt: 168,97 la viteza de scanare de 5mV / s.
În plus, a fost observat un timp bun de descărcare galvanostatică de 903 μs, o capacitate specifică mare de 2178,16 la densitatea curentului de 3 mA / Cm2. Densitatea de energie calculată de la descărcarea galvanostatică este de 108,91 Wh / Kg, la densitatea de curent de 3 mA / Cm2.
Impedanța electrochimică confirmă astfel natura pseudo-capacitivă a electrodului ierarhic de nano-coliziune Al2S3. Testul de stabilitate a electrozilor arată o reținere de 57,44% a capacității specifice de până la 1000 de cicluri.
Rezultatele experimentale sugerează că nanorambutantul Al2S3 Ierarhic este potrivit pentru aplicațiile supercapacitor.
În bateriile secundare cu litiu
Cu intenția de a dezvolta o baterie secundară de litiu cu densitate mare de energie, sulfura de aluminiu (Al2S3) ca material activ.
Capacitatea de descărcare inițială măsurată de la Al2S3 a fost de aproximativ 1170 mAh g-1 la 100 mA g-1. Aceasta corespunde la 62% din capacitatea teoretică pentru sulf.
Al2S3 a prezentat o retenție slabă a capacității în intervalul potențial între 0,01 V și 2,0 V, în principal datorită ireversibilității structurale a procesului de încărcare sau a extracției Li.
Analizele XRD și K-XANES pentru aluminiu și sulf au indicat că suprafața Al2S3 reacționează reversibil în timpul proceselor de încărcare și descărcare, în timp ce miezul Al2S3 a arătat ireversibilitatea structurală, deoarece LiAl și Li2S au fost formate din Al2S3 în descărcarea inițială și apoi au rămas așa cum erau.
riscuri
- În contact cu apa eliberează gaze inflamabile care pot arde spontan.
- Provoacă iritarea pielii.
- Provoacă o iritare gravă a ochilor.
- Poate provoca iritații respiratorii.
Informațiile pot varia între notificări în funcție de impurități, aditivi și alți factori.
Procedura de prim ajutor
Tratamentul general
Solicitați asistență medicală dacă simptomele persistă.
Tratament special
nici unul
Simptome importante
nici unul
inhalare
Scoateți victima în aer liber. Dați oxigen dacă respirația este dificilă.
ingerare
Administrați una sau două pahare de apă și provocați vărsături. Nu induceți niciodată voma sau nu dați nimic oral unei persoane inconștiente.
piele
Spălați zona afectată cu apă și săpun ușor. Scoateți orice îmbrăcăminte contaminată.
ochi
Spălați-vă ochii cu apă, clipește adesea timp de câteva minute. Îndepărtați lentilele de contact în cazul în care le aveți și continuați clătirea.
Măsuri de combatere a incendiilor
caracter inflamabil
Nu este inflamabil
Mijloace de stingere
Reacționează cu apă. Nu utilizați apă: utilizați CO2, nisip și pulbere de stingere.
Procedura de luptă
Utilizați un aparat de respirat autonom cu toată protecția, cu protecție completă. Purtați haine pentru a evita contactul cu pielea și ochii.
referințe
- Salud y Riesgos.com, (s.f), Definiție, concepte și articole privind sănătatea, riscurile și mediul. Recuperat: saludyriesgos.com
- Sulfura de aluminiu. (S.f). Pe Wikiwand. Adus pe 9 martie 2018: wikiwand.com
- Elemente Web (S.f) .Dialuminiu Trisulpfide, recuperat la 10 martie 2018: webelements.com
- Iqbal, M., Hassan, M., M., Bibi S., Parveen, B. (2017). Capacitate specifică ridicată și densitate de energie a nanoparticulei Al2S3 Nanorambutan ierarhic sintetizat pe bază de oxid de grafină pentru aplicația Supercapacitor, Electrochimica Acta, Volumul 246 , Paginile 1097-1103
- Senoh, H., Takeuchi, T., Hiroyuki K., Sakaebe, H., M., Nakanishi, K., Ohta, T., Sakai, T., Yasuda, K. (2010). Caracteristicile electrochimice ale sulfurii de aluminiu pentru utilizarea în bateriile cu litiu.Jurnalul surselor de alimentare,Volumul 195, Issue 24, Pages 8327-8330 doi.org
- LTS Research Laboratories, Inc (2016), Fișa tehnică de securitate Sulfura de aluminiu: ltschem.com



 nomenclatură
nomenclatură