Iodoat de potasiu Proprietăți, structură, utilizări și riscuri
iodat de potasiu sau iodatul de potasiu este un compus anorganic al iodului, în mod specific o sare, a cărui formulă chimică este KIO3. Iodul, element al grupului de halogeni (F, CI, Br, I, As), are în această sare un număr de oxidare de +5; din acest motiv este un agent puternic de oxidare. KIO3 disociază în mediu apos pentru a crea ionii de K+ și IO3-.
Se sintetizează prin reacția hidroxidului de potasiu cu acidul iodic: HIO3(aq) + KOH (s) => KIO3(aq) + H2O (l) De asemenea, poate fi sintetizat prin reacția iodului molecular cu hidroxid de potasiu: 3I2(s) + 6KOH (s) => KIO3(aq) + 5 KI (aq) + 3H2O (l)

index
- 1 Proprietăți fizice și chimice
- 1.1 Agent de oxidare
- 2 Structura chimică
- 3 Utilizări și aplicații de iodat de potasiu
- 3.1 Utilizare terapeutică
- 3.2 Utilizare în industrie
- 3.3 Utilizare analitică
- 3.4 Utilizați tehnologia laserelor
- 4 Riscuri de sănătate ale iodatului de potasiu
- 5 Referințe
Proprietăți fizice și chimice
Este un solid alb inodor, cu cristale fine și o structură cristalină de tip monoclinic. Are o densitate de 3,98 g / ml, o greutate moleculară de 214 g / mol și are benzi de absorbție în spectrul infraroșu (IR).
Are un punct de topire: 833 K (560 ºC), în concordanță cu interacțiunile ionice puternice dintre ionii K+ și IO3-. La temperaturi mai ridicate, aceasta suferă o reacție de descompunere termică, eliberând oxigen molecular și iodură de potasiu:
2KIO3(s) => 2KI (s) + 3O2(G)
Are solubilități în apă variind de la 4,74g / 100mL la 0 ° C, până la 32,3 g / 100 ml la 100 ° C, generând soluții apoase incolore. În plus, este insolubil în alcool și acid azotic, dar este solubil în acid sulfuric diluat.
afinitatea sa pentru apă nu este vizibil, ceea ce explică de ce nu este higroscopică și nu există sub formă de săruri hidratate (KIO3· H2O).
Agent de oxidare
Iodatul de potasiu, după cum indică formula sa chimică, are trei atomi de oxigen. Acesta este un element puternic electronegativ și din cauza acestei proprietăți, să „descoperit“ o deficiență electronică în nor care înconjoară iod.
Această deficiență sau de intrare, deoarece între litere poate fi calculată ca numărul de oxidare iod (± 1, +2, +3, +5, +7), fiind +5 în cazul acestei sări.
Ce înseamnă asta? Că înainte de o specie capabilă să-și dea electronii, iodul îi va accepta în forma lor ionică (IO3-) pentru a deveni iod molecular și au un număr de oxidare egal cu 0.
După această explicație, se poate determina că iodatul de potasiu este un compus oxidant care reacționează puternic cu agenți reducători în multe reacții redox; Dintre toate acestea, unul este cunoscut ca ceasul de iod.
Ceasul de iod constă într-un proces redox de pași lenți și rapizi, în care pașii rapizi sunt marcați de o soluție KIO3 în acid sulfuric la care se adaugă amidonul. Apoi, amidonul - o dată produs și ancorat între speciile sale de structură I3-- va transforma soluția incoloră în albastru închis.
IO3− + 3 HSO3− → I− + 3 HSO4−
IO3− + 5 I− + 6 H+ → 3 I2 + 3 H2O
eu2 + HSO3− + H2O → 2 I− + HSO4− + 2 H+ (albastru închis prin efectul amidonului)
Structura chimică
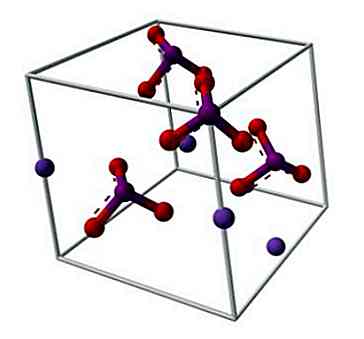
Structura chimică a iodatului de potasiu este ilustrată în imaginea superioară. Anionul IO3- este reprezentat de "trepiedul" sferelor roșii și purpurii, în timp ce Kionii+ ele sunt reprezentate de sferele purpurii.
Dar ce înseamnă aceste trepieduri? Corecte formele geometrice ale acestor anioni sunt de fapt piramide trigonale, în care oxigenii formează baza triunghiulară, iar perechea unshared de puncte electroni de iod în sus, care ocupă spațiu și forțând rabatați legătura IO și cele două link-uri I = O.
Această geometrie moleculară corespunde unei hibridizări sp3 a atomului central de iod; totuși, o altă perspectivă sugerează că unul dintre atomii de oxigen formează legături cu orbitele "d" ale iodului, fiind de fapt o hibridizare sp3d2 (iodul poate avea orbitele "d" să-și extindă stratul de valență).
Cristalele acestei sări pot suferi tranziții de fază structurale (alte aranjamente altele decât monoclinic), ca urmare a diferitelor condiții fizice care fac obiectul.
Utilizări și aplicații de iodat de potasiu
Utilizare terapeutică
Iodatul de potasiu este utilizat, de obicei, pentru a preveni acumularea de radioactivitate în tiroidă sub formă de 131I, când acest izotop este utilizat în determinarea absorbției de iod de către tiroidă ca o componentă a funcționării glandei tiroide.
De asemenea, iodatul de potasiu este utilizat ca un antiseptic topic (0,5%) în infecțiile mucoasei.
Utilizați în industrie
Se adaugă la hrana animalelor de fermă ca supliment de iod. Prin urmare, în industrie, iodatul de potasiu este utilizat pentru a îmbunătăți calitatea făinii.
Utilizare analitică
În chimia analitică, datorită stabilității sale, este utilizată ca standard primar în standardizarea soluțiilor standard tiosulfat de sodiu (Na2S2O3), în scopul determinării concentrațiilor de iod în problemele probelor.
Aceasta înseamnă că cantitățile de iod pot fi cunoscute prin tehnici volumetrice (titrări). În această reacție, iodatul de potasiu oxidează rapid ionii de iodură I-, prin următoarea ecuație chimică:
IO3- + 5I- + 6H+ => 3I2 + 3H2O
Iod, eu2, se titrează cu soluția de Na2S2O3 pentru standardizarea sa.
Utilizați tehnologia laserelor
Studiile au demonstrat și au confirmat proprietățile interesante piezoelectrice, piroelectrice, electro-optice, feroelectrice și în optica neliniară a cristalelor KIO3. Acest lucru are ca rezultat un potențial mare în domeniul electronic și în tehnologia de lasere pentru materialele fabricate cu acest compus.
Riscuri de sănătate ale iodatului de potasiu
În doze mari poate provoca iritarea mucoasei orale, a pielii, a ochilor și a tractului respirator.
Experimentele privind toxicitatea iodatului de potasiu la animale au arătat că la câini de născut, la o doză de 0,2-0,25 g / kg greutate corporală administrat oral, compusul provoacă vărsături.
Dacă aceste vărsături sunt evitate, aceasta cauzează o agravare a situației la animale, deoarece induce anorexie și prostație înainte de moarte. Autopsiile sale au permis să observe leziunile necrotice în ficat, rinichi și mucoasa intestinală.
Datorită puterii sale de oxidare, reprezintă un risc de incendiu atunci când intră în contact cu materiale inflamabile.
referințe
- Ziua, R., & Underwood, A. Chimie analitică cantitativă (ediția a cincea). PEARSON Prentice Hall, p-364.
- Muth, D. (2008). Lasere [Figura]. Adus de la: flickr.com
- ChemicalBook. (2017). Iodat de potasiu. Adus pe 25 martie 2018 de la ChemicalBook: chemicalbook.com
- Extract. (2018). Iodat de potasiu. Adus pe 25 martie 2018, de la PubChem: pubchem.ncbi.nlm.nih.gov
- Merck. (2018). Iodat de potasiu. Adus pe 25 martie 2018 de la Merck:
- merckmillipore.com
- Wikipedia. (2017). Iodat de potasiu. Adus pe 25 martie 2018, de pe Wikipedia: en.wikipedia.org
- M M Abdel Kader și colab. (2013). Mecanism de transport de încărcare și tranziții în fază de temperatură joasă în KIO3. J. Phys.: Conf. Ser 423 012036


