Oxizi de azot (NOx) Diferite formulări și nomenclaturi
oxizi de azot ele sunt în esență compuși anorganici gazoși care conțin legături între atomii de azot și oxigen. Formula chimică a grupului este NUx, indicând faptul că oxizii au proporții diferite de oxigen și azot.
Azotul conduce grupul 15 din tabelul periodic, în timp ce grupul de oxigen 16; ambele elemente sunt membre ale perioadei 2. Această apropiere este motivul pentru care legăturile N-O sunt covalente în oxizi. În acest fel, legăturile din oxizii de azot sunt covalente.
Toate aceste legături pot fi explicate folosind teoria orbitalei moleculare, care dezvăluie paramagnetismul (un electron nepereche în ultimul orbital molecular) al unora dintre acești compuși. Dintre aceștia, compușii cei mai obișnuiți sunt oxidul nitric și dioxidul de azot.
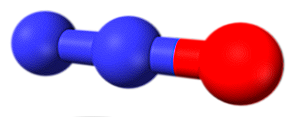
Molecula din imaginea superioară corespunde structurii angulare de fază gazoasă a dioxidului de azot (NO2). Dimpotrivă, oxidul nitric (NO) are o structură liniară (având în vedere hibridizarea sp pentru ambii atomi).
Oxizii de azot sunt gazele produse de numeroase activități umane, de la conducerea vehiculelor sau de la fumatul țigaretelor până la procesele industriale ca deșeuri poluante. Cu toate acestea, NO este produs în mod natural prin reacții enzimatice și fulgere în furtuni: N2(g) + O2(g) => 2NO (g)
Temperaturile ridicate ale razelor sparge bariera energetică care împiedică apariția acestei reacții în condiții normale. Ce barieră energetică? Aceasta formată prin legătura triplă N≡N, făcând molecula N2 un gaz inert din atmosferă.
index
- 1 Numere de oxidare pentru azot și oxigen în oxizii lor
- 2 Diferite formulări și nomenclaturi
- 2.1 Oxid de azot (N2O)
- 2.2 Oxidul nitric (NO)
- 2.3 Trioxid de azot (N2O3)
- 2.4. Dioxidul și tetroxidul de azot (NO2, N2O4)
- 2.5 Pentoxid de azot (N2O5)
- 3 Referințe
Numerele de oxidare pentru azot și oxigen în oxizii lor
Configurația electronică pentru oxigen este [He] 2s22p4, necesitând numai doi electroni pentru a finaliza octetul învelișului de valență; adică, poate câștiga doi electroni și poate avea un număr de oxidare egal cu -2.
Pe de altă parte, configurația electronică a azotului este [He] 2s22p3, fiind capabili să câștige până la trei electroni pentru a umple octetul valenței; de exemplu, în cazul amoniacului (NH3) are un număr de oxidare egal cu -3. Dar oxigenul este mult mai electonegativ decât hidrogenul și "forțează" azotul pentru a-și împărți electronii.
Câți electroni pot împrăștia azot cu oxigenul? Dacă împărțiți electronii valenței dvs. unul câte unul, veți ajunge la limita a cinci electroni, corespunzând unui număr de oxidare de +5.
În consecință, în funcție de numărul de legături pe care le formează cu oxigenul, numerele de oxidare ale azotului variază de la +1 la +5.
Diferite formulări și nomenclaturi
Oxizii de azot, în ordinea crescătoare a numărului de oxizi de azot, sunt:
- N2Sau, oxidul de azot (+1)
- NO, oxid nitric (+2)
- N2O3, trioxid de azot (+3)
- Nu2, dioxid de azot (+4)
- N2O5, pentoxid de azot (+5)
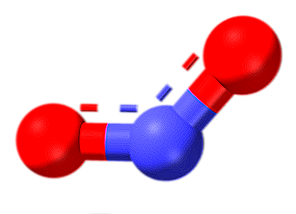
Oxid de azot (N2O)
Oxidul de azot (sau popular cunoscut sub numele de gaz de râs) este un gaz incolor, cu un miros ușor dulce și puțin reactiv. Acesta poate fi vizualizat ca o moleculă N2 (sfere albastre) care a adăugat un atom de oxigen la un capăt. Se prepară prin descompunerea termică a sărurilor de nitrați și se utilizează ca anestezic și analgezic.
Azotul are un număr de oxidare de +1 în acest oxid, ceea ce înseamnă că acesta nu este foarte oxidat și că cererea de electroni nu este convingătoare; totuși, trebuie doar să câștigi doi electroni (unul pentru fiecare azot) pentru a deveni azot molecular stabil.
În soluțiile bazice și acide reacțiile sunt:
N2O (g) + 2H+(ac) + 2e- => N2(g) + H2O (l)
N2O (g) + H2O (l) + 2e- => N2(g) + 2OH-(Aq)
Aceste reacții, deși termodinamic, sunt favorizate prin formarea moleculei stabile N2, ele apar încet, iar reactivii care dau perechea de electroni trebuie să fie agenți reducători foarte puternici.
Oxidul de azot (NO)
Acest oxid constă dintr-un gaz incolor, reactiv și paramagnetic. Ca și oxidul de azot, are o structură moleculară liniară, dar cu mare diferență că legătura N = O are de asemenea un caracter de legătură triplă.
NU se oxidează rapid în aer pentru a produce NO2, generând astfel orbitale moleculare mai stabile cu un atom de azot mai oxidat (+4).
2NO (g) + O2(g) => 2NO2(G)
Studiile biochimice și fiziologice se află în spatele rolului benign al acestui oxid în organismele vii.
Nu poate forma legături N-N cu o altă moleculă de NO datorită delocalizării electronului nelegat în orbita moleculară, care este direcționat mai mult spre atomul de oxigen (datorită electronegativității sale ridicate). Opusul are loc cu NO2, care pot forma dimeri gazoși.
Trioxid de azot (N2O3)
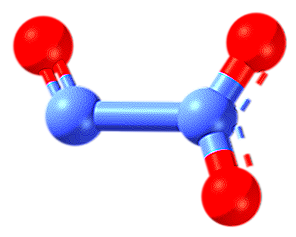
Liniile punctate ale structurii indică rezonanța legăturii duble. Ca toți atomii, au hibridizare sp2, molecula este plat și interacțiunile moleculare sunt suficient de eficiente pentru ca trioxidul de azot să existe ca un solid albastru sub -101 ° C. La temperaturi mai mari se topește și se disociază în NO și NO2.
De ce este disociată? Deoarece numerele de oxidare +2 și +4 sunt mai stabile decât +3, acestea din urmă sunt prezente în oxid pentru fiecare dintre cei doi atomi de azot. Aceasta, din nou, poate fi explicată prin stabilitatea orbitalilor moleculare care rezultă din disproporție.
În imagine, partea stângă a lui N2O3 corespunde NO, în timp ce partea dreaptă a NO2. În mod logic, este produsă prin coalescența oxizilor anteriori la temperaturi foarte scăzute (-20 ° C). N2O3 este anhidrida acidului azotic (HNO2).
Dioxidul și tetroxidul de azot (nr2, N2O4)
NU2 este un gaz maro sau maro, reactiv și paramagnetic. Deoarece are un electron neparat, dimerizează (se leagă) cu o altă moleculă gazoasă NO2 pentru a forma tetroxid de azot, gaz incolor, stabilind un echilibru între ambele specii chimice:
2NO2(g) <=> N2O4(G)
Este un agent oxidant otrăvitor și versatil, capabil să fie disproporționat în reacțiile sale redox în ioni (oxoanioane).2- și NU3- (generatoare de ploi acide) sau în NO.
De asemenea, NO2 este implicat în reacții atmosferice complexe care cauzează variații ale concentrațiilor de ozon (O.3) la nivel terestru și în stratosferă.
Pentoxidul de azot (N2O5)
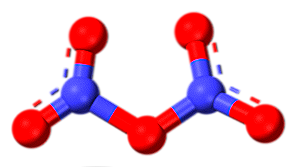 Pentoxidul de azot este un solid cristalin, anhidrida acidului azotic (HNO)3), și este forma cea mai oxidat, prin urmare, cel mai oxidant de azot. În faza gazoasă are o structură moleculară așa cum este ilustrată de imagine, dar într-o fază solidă oxidul este alcătuit din ioni de NO2+ și NU3-.
Pentoxidul de azot este un solid cristalin, anhidrida acidului azotic (HNO)3), și este forma cea mai oxidat, prin urmare, cel mai oxidant de azot. În faza gazoasă are o structură moleculară așa cum este ilustrată de imagine, dar într-o fază solidă oxidul este alcătuit din ioni de NO2+ și NU3-.
Când este hidratat, acesta generează HNO3, iar la concentrații mai ridicate de acid, oxigenul este în principal protonat cu sarcină parțială pozitivă -O+-H, accelerând reacțiile redox
referințe
- askIITians. ((2006-2018)). askIITians. Adus pe 29 martie 2018, de la askIITians: askiitians.com
- Encyclopaedia Britannica, Inc. (2018). Enciclopedia britanică. Adus pe 29 martie 2018, de la Enciclopedia Britannica: britannica.com
- Tox Town. (2017). Tox Town. Adus pe 29 martie 2018, din Tox Town: toxtown.nlm.nih.gov
- Profesorul Patricia Shapley. (2010). Oxizi de azot în atmosferă. Universitatea din Illinois. Adus pe 29 martie 2018, de la: butane.chem.uiuc.edu
- Shiver & Atkins. (2008). Chimie anorganică în Elementele grupului 15. (Ediția a patra, pp. 361-366). Mc Graw Hill